I-Introduction
I - Introduction
Problématique :
En quoi le milieu influe-t-il
sur l'oxydation d'un fruit
tel que la pomme ?
Vous avez tous, cuisiniers en herbe, sûrement déjà coupé et laissé des pommes dans un endroit quelconque. Après quelques minutes vous vous êtes rendu compte que celles-ci s'étaient détériorées et avaient pris une teinte brunie. C'est alors que vous vous êtes dits :
« Mince, les pommes se sont oxydées ! »
Nous nous sommes alors demandés ce qui était responsable de cette altération de l'aliment et quels moyens nous avions pour pallier à ce problème.
Il nous a fallu tout d'abord, pour comprendre comment s'effectuait l'oxydation sur la pomme, en connaître la composition.
La composition de la pomme :
La pomme contient initialement de la quercétine, composé chimique appartenant à la famille des polyphénols*, qui est divisée en plusieurs catégories, dont celle des flavonoïdes* contenant elle-même des sous-groupes dont celui des flavonols* dans lequel se trouve la quercétine .

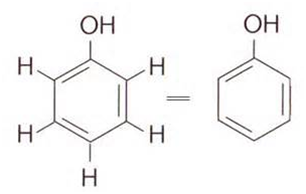
Formule topologique d’un phénol.
( caractérisé par un groupe hydroxyle –OH fixé sur un cycle benzénique )
Un polyphénol contient lui plusieurs substituants hydroxyle –OH.

Formule topologique de la quercétine de formule brute C15H10O7
La pomme contient également une enzyme appelée phénoloxydase ( abrégée PPO ), elle est quant à elle contenue dans le cytoplasme. La quercétine et l’enzyme sont donc deux éléments naturellement séparés par une fine membrane.
Après cela nous avons dû comprendre ce qu'était l'oxydation.
L’oxydation
Dans le langage courant , l'oxydation est la réaction chimique dans laquelle un composé se combine avec un ou plusieurs atomes d'oxygène ( Comme l'oxydation du fer qui produit la rouille ).
Or l’oxydation se qualifie comme une perte d’électrons. Cette perte ne peut se produire que s’il existe un corps susceptible de les accepter, c’est le concept d’oxydoréduction.
( Ce modèle a été introduit après la découverte de l’électron par Joseph John Thomson en 1897 ).
L’élément qui cède un ou plusieurs électrons est appelé « réducteur », et l’élément qui captera les électrons cédés est appelé « oxydant ». Le phénomène inverse de l’oxydation est celui de l’acceptation des électrons, il est appelé la réduction.
Une oxydation est donc forcément accompagnée d’une réduction.

Schéma de la réaction d’oxydoréduction.
Le mécanisme du brunissement enzymatique :
L'oxydation produite sur les fruits et surtout sur la pomme est une réaction observable à l’œil nu, c'est le brunissement enzymatique. Mais qu'est-ce donc d'un point de vue scientifique ?
Lorsque l’on coupe une pomme en morceaux, on coupe les fines membranes du fruit et ainsi les polyphénols, contenus initialement à l’intérieur du fruit, sont désormais au contact de l’air.
Ainsi l’enzyme PPO et la quercétine ne seront plus séparées par une membrane comme elles l’étaient auparavant et ces deux éléments vont alors réagir ensemble. L’enzyme va jouer le rôle de catalyseur* de l’oxydation ( la quercétine sera le substrat* et l’ortho-quinone sera le produit* ) c'est à dire qu'elle va se combiner avec la quercétine par action de l’oxygène.

Schéma représentant l’oxydation du substrat par l’action catalytique d’une enzyme.
Les phénols vont alors s’oxyder avec l’oxygène en ortho-quinones. Les quinones sont des molécules possédant une série de diènes* à la place des composés aromatiques*.
Les quinones sont des molécules dérivées du cycle benzénique dans laquelle deux atomes de carbone portent des doubles liaisons telles que : C=O.
Ces ortho-quinones vont donc perdre leur noyaux aromatiques, et c'est donc, en partie, l'explication de la perte du goût du fruit oxydé.
L’ortho-quinone est ici le réducteur formé après l’oxydation des phénols, l’oxydant étant le dioxygène contenu dans l’air.

Molécule de quinone

Équation de l’oxydation de la quercétine en ortho-quinone.
Nous pouvons en conclure que les phénols s’oxydent avec l’oxygène grâce à l’action de l’enzyme PPO. Nous nous sommes donc ensuite intéressés à l’action qu’a l’oxygène pour produire l’oxydation.
Tous les corps sont composés d’atomes, ceux qui ont une couche externe complète d’électrons sont stables et n'entrent pas en réaction chimique avec d’autres atomes ou molécules. Par contre, il existe des atomes instables, qui ne possèdent pas une couche externe complète d’électrons, ils recherchent alors des électrons afin de devenir stables. Ces atomes instables sont appelés radicaux libres.
Les radicaux libres, afin de devenir stables, ont tendance à voler des électrons à n’importe quelle molécule. Cette dernière deviendra à son tour instable et donc un radical libre. Les radicaux libres sont donc la cause de réactions en chaine.
Dans la pomme les radicaux libres observés sont les radicaux libres d’oxygène, ce sont donc des atomes d’oxygène auxquels il manque un ou plusieurs électrons sur leur couche externe : ils sont à l’origine de l’oxydation.
Afin de bloquer l’action de ces radicaux libres, il faut leur céder le ou les électrons qu’ils recherchent et pour cela il faut qu’un antioxydant intervienne. Or nous savons que la pomme est le fruit qui possède le moins de flavonol ( le flavonol contenu dans la pomme étant la quercétine ) alors que ces constituants sont des éléments aux fortes propriétés antioxydantes. Et bien que la pomme soit un fruit très riche en vitamine C qui est également un antioxydant, nous constatons que cela n’est pas suffisant pour empêcher l’oxydation.
Ainsi nous avons cherché à formuler l'équation d'oxydoréduction ( abrégée équation redox ) de cette transformation chimique pour la pomme.
Il est donné la formule théorique de l’oxydoréduction schématisé ainsi :

Avant de trouver cette équation bilan nous devons déterminer les deux demi-équations redox :
Demi-équation redox :
1) Ox(1) + n(1) e- → Red(1)
→ [ Quercétine + 2e- + 2H+ → Ortho-quinone ] *2
2) Red(2) → n(2) e- + Ox(2)
→ 2H2O → O2 + 4 e- + 4H+
Équation bilan :
Ox(2) + Red(1) → Ox(1) + Red(2)
[O2 + 4 e- + 4H+] + [ 2Ortho-quinone ] → [ 2Quercétine + 4e- + 4H+] + [ 2H2O]
Ortho-quinone + O2 → Quercétine + 2H2O
« Ox » correspond à l’oxydant, à la fin de la réaction entre l’oxydant et les électrons, on dira que l’oxydant a été réduit, on obtient ainsi le réducteur appelé « Red ».
L’ortho-quinone ainsi formée va ensuite elle-même s’oxyder sans l’aide d’une enzyme particulière pour catalyser la réaction, puis se polymérisera en mélanine* qui est à l’origine du brunissement de la pomme.
Schéma bilan
LEXIQUE
Poly/Phénols* : Ce sont des alcools ( de formule brute C6H6O mais dont on retrouve différents isomères au sein du fruit ) possédant des propriétés aromatiques comme notamment le goût du fruit.
Flavonoïdes* : Ils sont présents dans les végétaux et sont responsables de la couleur variée de ces derniers ( fleurs et fruits par exemple ), ils représentent une source importante d’antioxydant.
Flavonols* : C’est l’un des sous-groupe des flavonoïdes ( ils donnent aux végétaux une pigmentation jaune plus ou moins clair ). Parmi eux se trouve la quercétine qui est le plus actif des flavonols et qui détient des propriétés d’antioxydants.
Phénoloxydase* : une enzyme est qualifiée de phénoloxydase lorsqu’elle tient le rôle de catalyseur* de l’oxydation d’un phénol.
Catalyseur* : substance qui accélère la vitesse d’une réaction biochimique sans être altérée dans le processus.
Substrat* : molécule qui entre en réaction et sera transformée par l’action catalytique de l’enzyme.
Produit* : molécule qui apparaît au cours de la réaction catalysée par l’enzyme.
Diène* : hydrocarbure contenant deux doubles liaisons.
Composé aromatique* : composé organique contenant un système cyclique respectant la règle d’aromaticité de Hückel. Chez les hydrocarbures le modèle est le benzène C6H6 qui forme un hexagone régulier dans lequel trois liaisons doubles alternent avec trois liaisons simples.
Mélanine* : pigment brun que l’on retrouve également chez l’homme.


/https%3A%2F%2Fstorage.canalblog.com%2F91%2F48%2F1333255%2F102412546_o.jpg)
/https%3A%2F%2Fassets.over-blog.com%2Ft%2Fcedistic%2Fcamera.png)